研究内容
トピックス
3. 新規細胞死抑制剤Indolylmaleimide(IM)化合物の開発と虚血再灌流障害における保護効果
4. 細胞内の低分子化合物を観察する技術の開発 ~アルキンを目印にしたラマンイメージング~
5. 生物活性化合物の結合タンパク質および結合部位同定に向けた新手法の開発
1. 生物活性物質の効率的な合成を目指した方法論の開発
私達の研究室では、特徴的な生理活性を示す分子を効率的に合成することを目的に新しい有機合成反応の開発に取り組んでいます。
1) フッ素に着目した有機合成
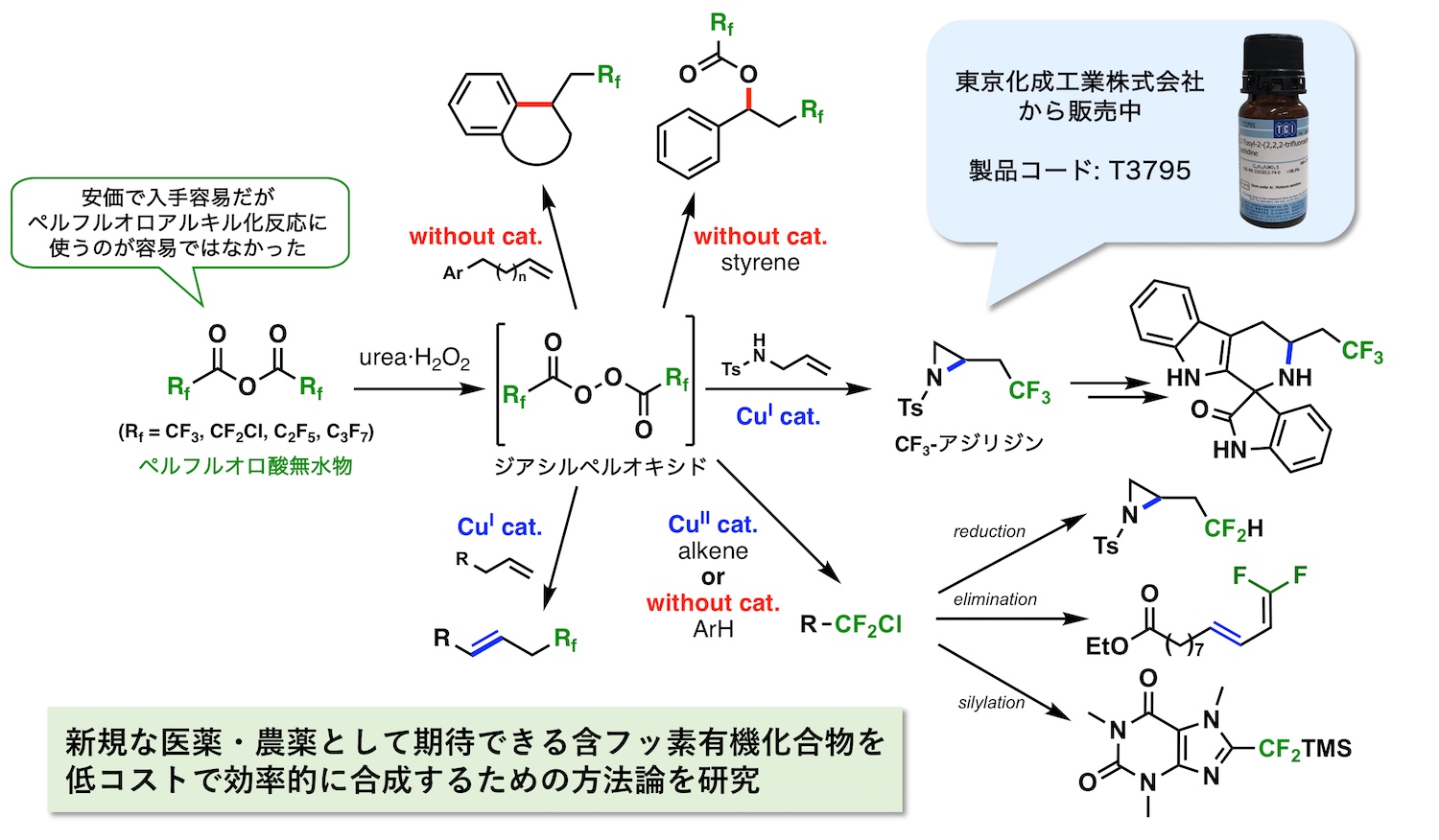
フッ素は全ての元素の中で最も高い電気陰性度を有し、原子半径が比較的小さいことから他の元素にはない特徴的な性質を示すことがあります。医薬や農薬の開発においては、細胞膜の透過性や代謝に対する安定性の向上を目的に、フッ素を生理活性分子に導入する試みがなされます。すなわち、フッ素を有機分子に導入できれば、薬物動態 (吸収、分布、代謝、排泄) が改善され、少量で効能の高い医薬・農薬となることが期待できます。このため、近年上市した医薬・農薬の多くに含フッ素化合物が見られます。また、含フッ素化合物は、MRIやPETイメージングの造影剤としての利用も注目されており、その需要は高まっています。しかし、天然に存在する含フッ素分子は数十種類しか知られておらず、有機合成によって様々な骨格を有する分子をつくる必要があります。
我々の研究室では、含フッ素化合物の新規かつ効率的な合成反応の開発・研究を行なっています。特に、最近ではアルキル基 (CnH2n+1) の水素がフッ素で置換されたフルオロアルキル基 (CnF2n+1) を導入するペルフルオロアルキル化反応の開発に取り組んでいます。ペルフルオロアルキル源になる試薬の元素および分子化学的な性質を研究することで、これまでに様々な新規フルオロアルキル化合物を効率的に合成することに成功してきました。我々の開発した反応によって得られる分子はさらなる変換が容易なものが多く、現在では多様な骨格を有する分子が現在合成できるようになりました。中でもトリフルオロメチル基を有するアジリジン (含窒素三員環) は、さらなる官能基変換に対して特に有望な生成物であり、現在、東京化成工業株式会社から販売されています。
プレスリリース
- Chem-Station スポットライトリサーチ (2016年6月29日)
- RIKEN RESEARCH Research Highlights (2016年8月19日)
- RIKEN RESEARCH Research Highlights (2015年6月19日)
- RIKEN RESEARCH Research Highlights (2013年9月27日)
- RIKEN RESEARCH Research Highlights (2012年10月5日)
- RIKEN RESEARCH Research Highlights (2012年9月28日)
- RIKEN RESEARCH Research Highlights (2007年9月7日)
2) 触媒的不斉反応
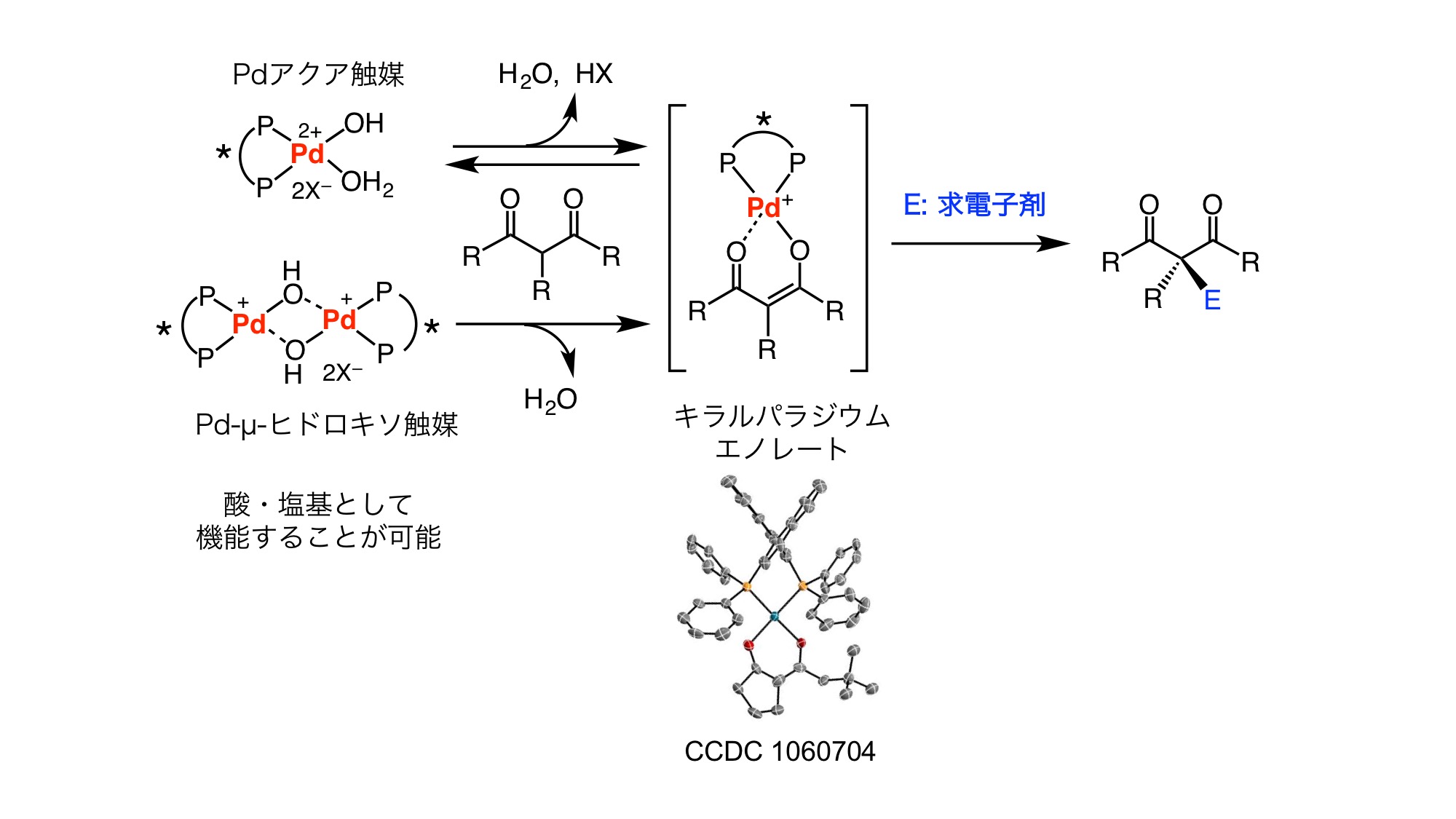
生体において核酸(DNA及びRNA)はD体の糖で構成されタンパク質は主にL体のアミノ酸で構成されています。そのため生物はキラル分子を識別できることから、生体高分子と選択的に相互作用するキラル分子の作製は、医薬や農薬の開発において重要です。私達は、パラジウムやニッケルなどの遷移金属のソフトな性質に着目し、新規な遷移金属錯体触媒や反応の開発を行っています。これらの遷移金属触媒は、水やアルコール溶媒中において、カルボニル化合物からキラルエノラートを発生させることができ、温和な条件下、様々な不斉反応を実現することができます。これまでに、不斉炭素−炭素結合形成反応、不斉フッ素化反応、不斉環化付加型反応、不斉カスケード反応などの開発を実現しており、多彩なキラル分子群の供給に成功しています。
プレスリリース
- RIKEN RESEARCH Research Highlights (2010年6月4日)
- RIKEN RESEARCH Research Highlights (2008年9月19日)
- RIKEN RESEARCH Research Highlights (2006年11月24日)
3) 新規錯体触媒の創製・構造解析
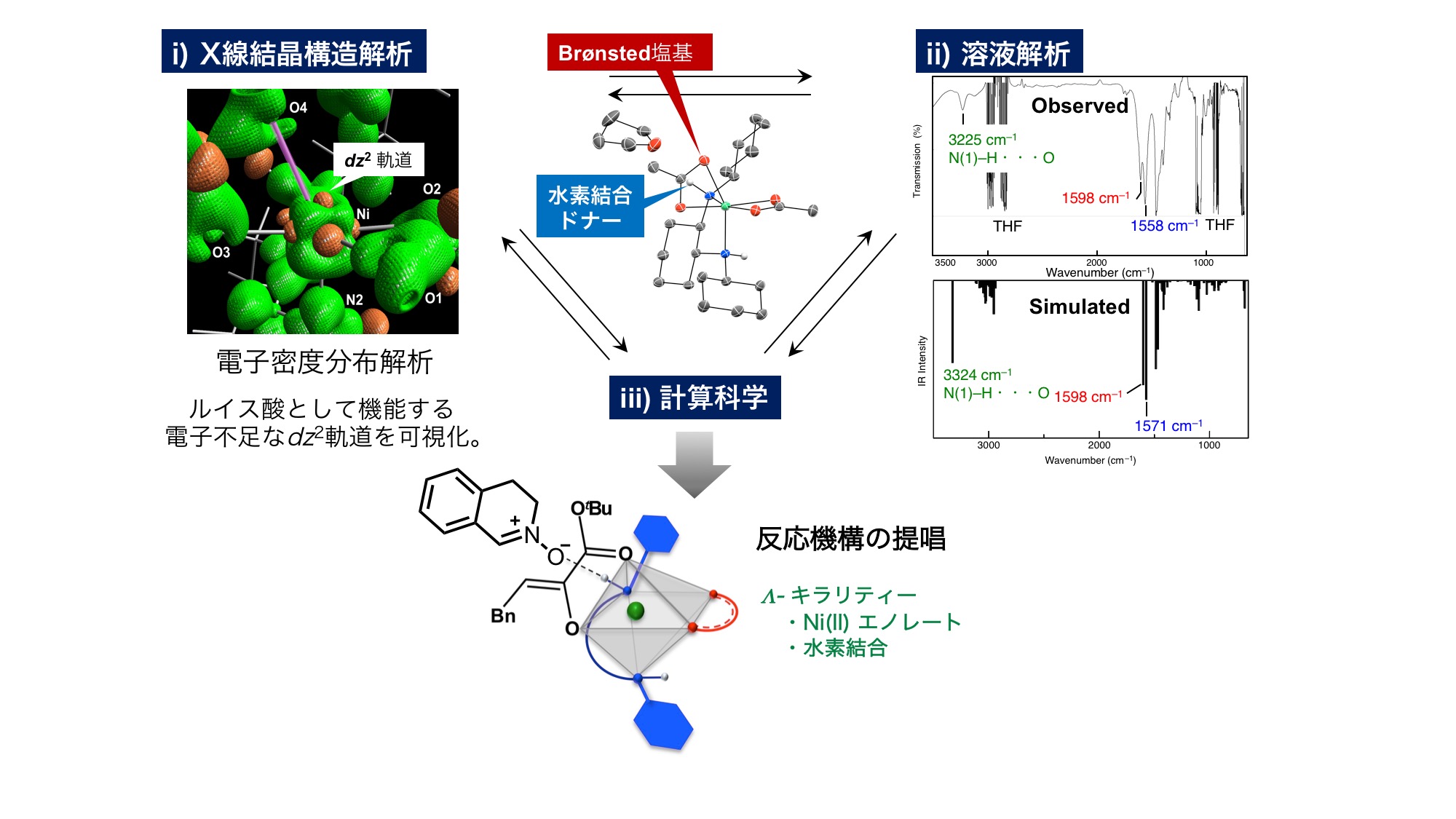
従来の研究では反応収率や選択性を指標に、金属塩と不斉配位子の種類や混合比を調整する試行錯誤を重ねることで、有用な触媒を見つけてきました。一方で、金属錯体触媒が反応基質をどのように活性化するのかを可視化できれば、より論理的かつ効率的に金属錯体触媒を開発することが可能になります。我々は、錯体触媒のX線結晶構造解析 (理学研究所 創発物性科学研究センター 物質評価支援チーム 橋爪大輔ユニットリーダーとの共同研究)・分光学的手法による溶液解析・計算科学 (理化学研究所 開拓研究本部 内山元素化学研究室との共同研究) を駆使することで、触媒的不斉反応の機構の解明に取り組んでいます。
プレスリリース
- RIKEN RESEARCH Research Highlights (2017年6月28日)
- Chem-Station スポットライトリサーチ (2017年6月15日)
- It Ain't Magic (2017年8月3日)
2. タンパク質メチル化反応を制御する低分子化合物の開発
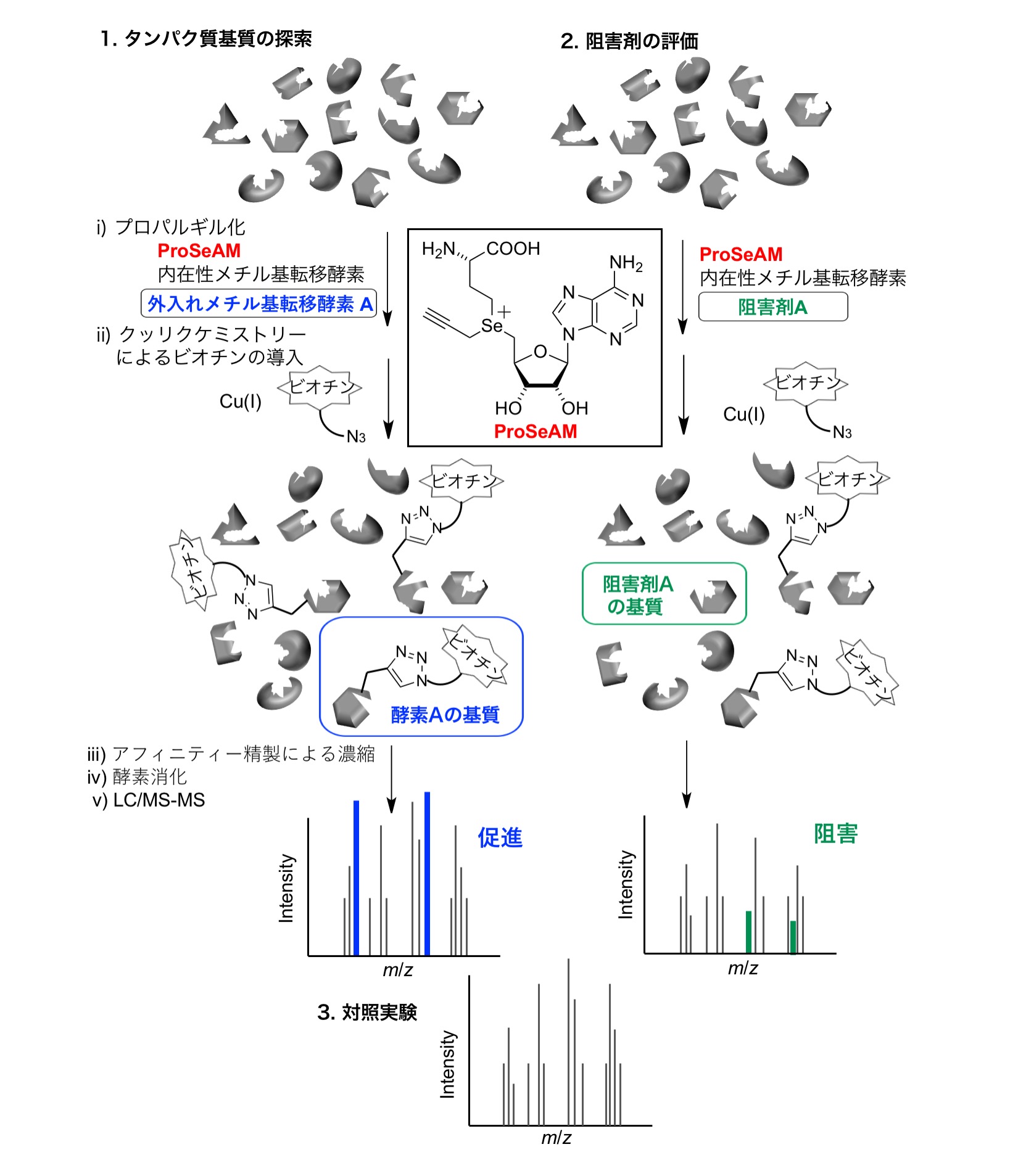
ヒストンのリジン (K) あるいはアルギニン (R) 残基のメチル化反応は、転写を司るクロマチン構造の変化に重要な役割を果たし、これにより多彩な生命現象が制御されることが明らかにされています。近年では、ヒストン以外のタンパク質(非ヒストン)のメチル化反応も生命現象の制御に重要な役割を果たすことが分かってきました。しかし、現在同定されている例は、実際に生体で起こるメチル化反応のほんの一部であり、その複雑なタンパク質メチル化反応の全容は分かっていません。私たちは、天然のメチル源SAM (S-adenosylmethionine) を合成化学的に改変した低分子化合物を検出プローブとして用いることで、人工的目印を基質タンパク質に導入する戦略で研究を進めています (理研 開拓研究本部 眞貝細胞記憶研究室との共同研究)。これまでに、「ProSeAM(propargylic Se-adenosyl-L-selenomethionine)」と呼ばれる化合物をプローブとして用いた場合、最も効率的にプロパルギル基(人工的目印)を基質タンパク質に導入できることを見出しています。ProSeAMによるプロパルギル化反応は、人工的に添加する精製したメチル基転移酵素の量に応答することを見出し、「どの酵素が、どのタンパク質をメチル化するのか」について紐付ける方法を開発しました (図左)。また、従来のタンパク質メチル化阻害剤の開発研究では、「1酵素-1基質-1サイト」のメチル化反応を指標に、阻害剤の構造最適化が進められてきましたが、私たちの手法により無数のタンパク質が存在する細胞抽出液において阻害剤のメチル化阻害能についても評価できるようになりました (図右)
プレスリリース
- Chem-Station スポットライトリサーチ (2018年9月15日)
- Cover picture in Chem. Rec. (2018年12月13日)
- RIKEN RESEARCH Research Highlights (2010年5月7日)
3. 新規細胞死抑制剤Indolylmaleimide(IM)化合物の開発と虚血再灌流障害における保護効果
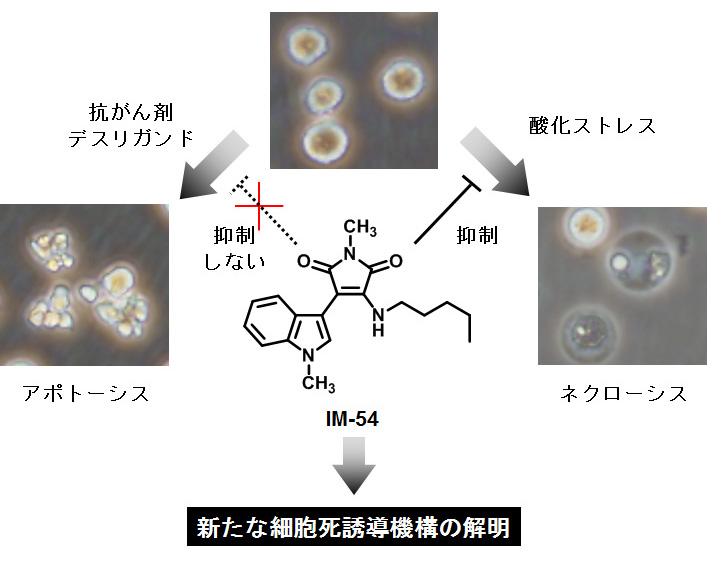
私たちの身体を構成する細胞は、分化や増殖を行い生体のホメオスタシスを維持しています。一方で近年、受動的な現象と考えられていた細胞の死も厳密に制御され、生命の維持に必要不可欠であることがわかってきています。中でも「アポトーシス」は細胞が自ら死へと至る能動的な細胞死として注目され、その特徴的な形態変化(細胞の縮小、blebbing、核の凝縮・断片化、アポトーシス小体の形成)と共にその分子機構が詳細に解明されてきました。これとは対照的に、「ネクローシス」は細胞が外界から物理的傷害を受けた時に誘導される受動的・非生理的な死として位置づけられ、永らく研究対象とはされませんでした。しかしながら近年、ある種のネクローシスでは誘導機構が存在することが明らかになり、虚血性疾患(心筋梗塞、脳梗塞)での関与が示唆されています。しかしながら、その生理的な意義や詳細な分子機構など依然未解明の部分が残されています。そのため、ネクローシスを抑制する化合物は、そのメカニズム解明の鍵になると考えられます。
このような背景で私たちは、生理的な細胞死誘導因子(デスリガンド)や抗がん剤により誘導されるアポトーシスは阻害せず、酸化ストレスによるネクローシスを特異的に抑制するIndolylmaleimide(IM)化合物IM-54の開発に成功しました。
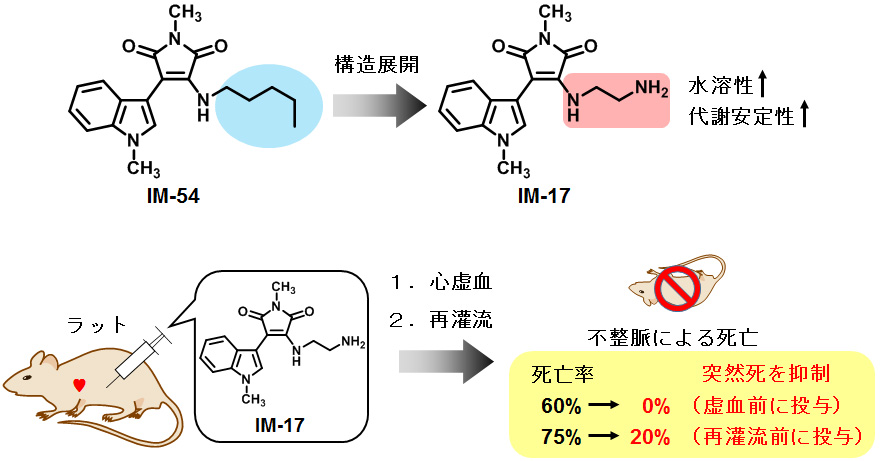
IM-54が抑制するネクローシスと疾患の関連性を検証すべく、疾患動物モデルへの適用を検討しましたが、その水溶性の低さが問題となりました。そこで水溶性を高めるべく水酸基やアミノ基を導入した誘導体を種々合成し、そのネクローシス抑制活性を比較しました。その結果、アルキル鎖の末端にアミノ基を導入したIM-17が、細胞レベルでの活性を維持しつつ、IM-54よりも高い水溶性をもつことがわかりました。さらに肝臓抽出液中での代謝安定性を調べたところ、IM-17はIM-54に比べ代謝安定性が大きく向上していることがわかりました。これらの結果を踏まえ、虚血再灌流障害モデルを用いてIM-17の心保護効果を検討することにしました。虚血再灌流障害とは、血栓が血管に詰まるなどの理由で血流が止まった後(虚血)、血流が再開した際に(再灌流)臓器に起きる障害です。その原因は完全にはわかっていませんが、酸化ストレスによるネクローシスとの関与が報告されています。心臓においては、虚血再灌流障害により心臓の拍動が乱れる不整脈が誘発され、突然死につながることがあります。そこでこの突然死に対して、IM-17が保護効果を示すかどうか調べたところ、死亡率の大幅な減少が見られました。さらにこの保護効果は、心虚血後に投与した場合においても同様に見られました。このことは、IM-17が虚血後投与でも保護作用を持つことを示し、虚血再灌流障害の治療に貢献する可能性を示唆しています。
プレスリリース
4. 細胞内の低分子化合物を観察する技術の開発 ~アルキンを目印にしたラマンイメージング~
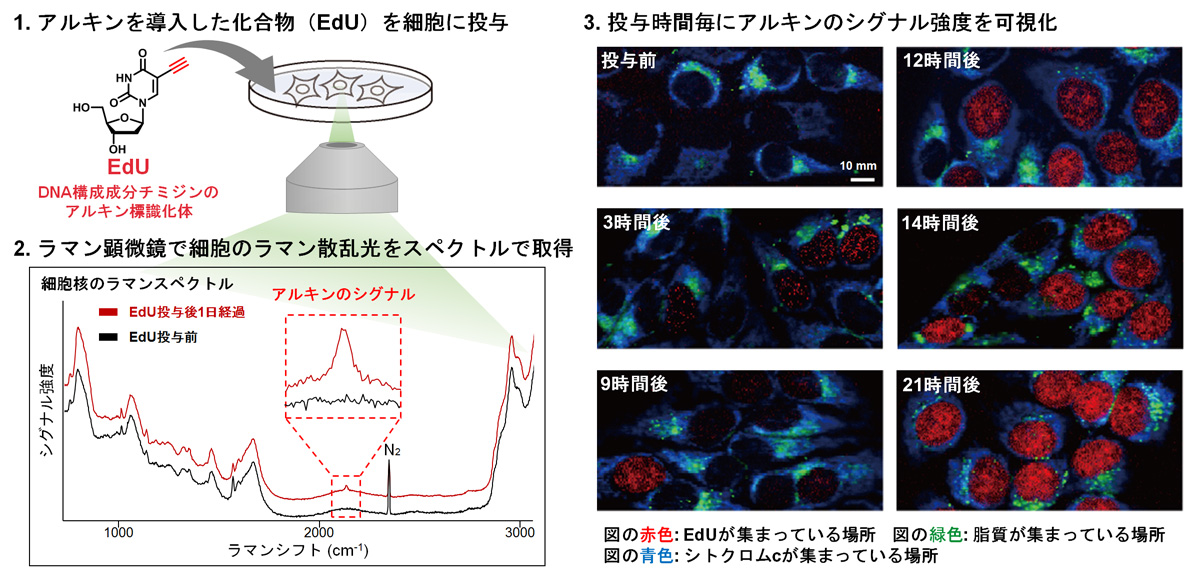
生体機能を司るタンパク質や化合物などの細胞内局在を観察する手法としては、蛍光団を導入して蛍光顕微鏡でイメージングする方法が一般的です。しかしながら蛍光団は大きな分子であるため、低分子化合物を対象とした場合はその生物活性を損なうケースが多々見られます。そこで私たちはこの問題を解決する手法として、ラマン顕微鏡を用いた低分子化合物のイメージング技術を開発しました(大阪大学 藤田教授らとの共同研究)。
ラマン顕微鏡は分子の振動状態を反映するラマン散乱光をもとに試料中の分子を直接同定・分析する顕微鏡です。私たちはアルキン(C≡C: 炭素―炭素の三重結合構造)が極めて小さな官能基でありながら、細胞内の生体分子が持たない特徴的かつ強いラマン散乱を示すことに着目し、低分子化合物の目印として使用することを考案しました。実際にDNAの構成成分であるdT (deoxythymidine) にアルキンを導入したEdU (5-ethynyl-2’-deoxyuridine) を細胞に投与してラマン顕微鏡で観察することで、EdUが経時的に核に取り込まれる様子が可視化できました。
私たちの開発したラマンイメージング技術は、人工膜上で形成された脂質ラフト構造の可視化(大阪大学 村田教授らとの共同研究)や植物病原菌が生産する感染因子の作用メカニズム解明研究(東北大学 上田教授らとの共同研究)、さらに生物活性化合物の結合タンパク質・結合部位同定への適用(5.生物活性化合物の結合タンパク質および結合部位同定に向けた新手法の開発)など、様々な分野の研究に貢献してきました。現在はラマンイメージングを様々な生物活性化合物の作用機序解明に応用することを目指し研究を展開しています。
プレスリリース
- 東北大学 プレスリリース (2017年5月17日)
- RIKEN RESEARCH Research Highlights (2015年7月17日)
- RIKEN RESEARCH Research Highlights (2013年4月12日)
- 理研ニュース (2011年6月号)
- RIKEN RESEARCH Research Highlights (2011年5月27日)
- JST プレスリリース (2011年3月22日)
5. 生物活性化合物の結合タンパク質および結合部位同定に向けた新手法の開発
ケミカルバイオロジー研究において、生物活性化合物の結合タンパク質やその結合部位の同定は、その作用機序解明において達成困難でありながら最も重要な課題の一つです。私たちは、その解決を目指し、生物活性化合物に導入できる小さなタグやユニットとそれを足掛かりとした検出法や精製法の開発を行っています。
1)Turn-ON型蛍光アフィニティーラベル化法:O-NBD法
蛍光アフィニティーラベル化法は、近傍のタンパク質と共有結合を形成できる反応性官能基と、検出を担う蛍光標識基の2つを導入したプローブ分子を用いて、生物活性化合物の標的タンパク質を蛍光で標識して同定する手法です。しかし、2つの官能基を導入することにより分子サイズの増加や性質の変化が生じ、生物活性化合物の活性が損なわれることが問題点として挙げられてきました。
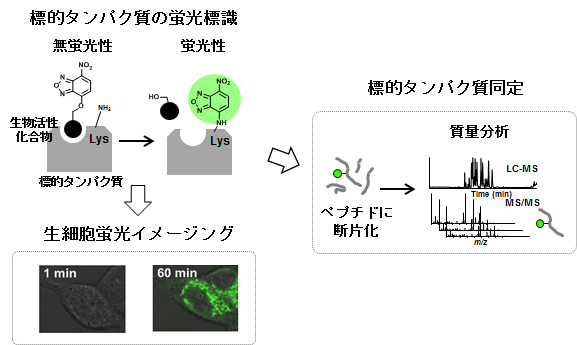
そこで私たちは、分子サイズが小さく、反応性官能基と蛍光標識基の両機能を備えたユニットとしてO-nitrobenzoxadiazole(NBD)を利用するTurn-ON型蛍光アフィニティーラベル化法を開発しました。O-NBDユニットはそれ自身無蛍光であるものの、リシン残基の持つアミノ基と反応して蛍光性のN-NBDへと変換されます。従って生物活性化合物にO-NBDユニットを導入すれば、標的タンパク質と結合しない状態では無蛍光ですが、標的タンパク質と結合した際に近傍のリシン残基と反応し、標的タンパク質を蛍光標識化することが可能となります(図参照)。そのためバックグラウンドが押さえられ、生細胞中で標的タンパク質の高感度な検出・イメージングができます。さらに蛍光を指標にして、NBD標識されたタンパク質およびアミノ酸部位を解析することで、標的タンパク質および結合部位の同定も可能にします。
プレスリリース
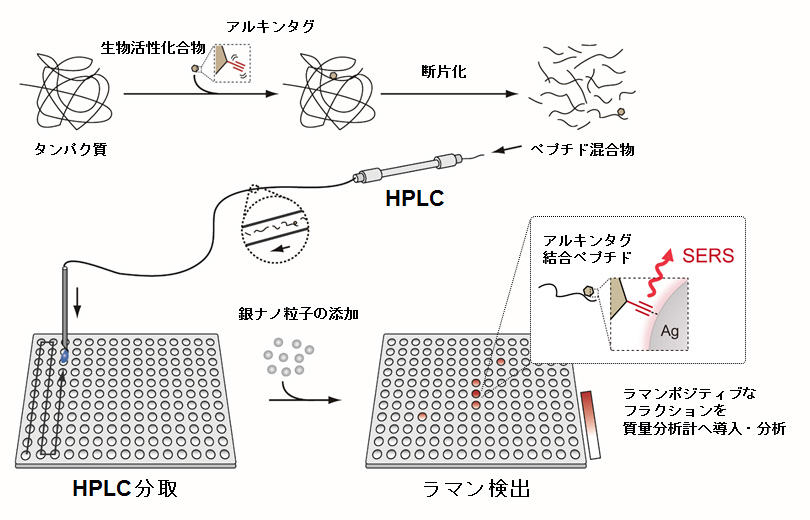
2)Alkyne-Tag Raman Screening (ATRaS)法
アルキンは炭素二つ分という小さな構造単位であるため、生物活性化合物に導入した場合でも、生物活性への影響を最小限に抑えられます。また、アルキンは生体成分がラマン散乱を示さない領域で特徴的かつ強いラマン散乱を示すことが知られており、私たちはラマン顕微鏡を用いて生細胞中でアルキン標識化合物を可視化することに成功しています(4. 細胞内の低分子化合物を観察する技術の開発:アルキンを目印にしたラマンイメージング)。そこで、このアルキンタグの検出技術を生物活性化合物が結合したペプチドの検出法へと展開し、ATRaS(Alkyne-Tag Raman Screening)法を開発しました。
本法はラマン分光法と他の分析法(HPLC、質量分析法)を組み合わせて、アルキン標識ペプチドを選択的に検出・分析する方法です。ラマン分光法でアルキン標識ペプチドを含むHPLC画分を探し出すことが出来るため、試料を効率よく質量分析計へ導入することが可能となります。この際には、表面増強ラマン散乱現象(SERS, Surface-Enhanced Raman Scattering)を利用して、銀ナノ粒子上でアルキンタグのラマンシグナルを増強させることが鍵となり、高感度検出を実現しました。実際に、システインプロテアーゼであるカテプシンBの阻害剤にアルキンタグを導入し、本法を適用したところ、阻害剤結合ペプチドおよび部位同定に成功しました。
他にも、アルキンタグの利用例として、コバルト錯体を用いて直接精製する手法も開発しました。現在はこれら手法を用いて、様々な生物活性化合物の標的タンパク質および結合部位同定を進めており、それらの作用機序解明への応用を目指しています。